で 原子力って結局 なんなのさ ( 恒星の一生と原子核 ) [読めばぁ~]
火力 → 天然ガス・石油等を燃料にし、高温・高圧の水蒸気でタービンを高速回転させる
原子力 (核分裂) → ウランなどの"特別な元素"を使い、「火」を出さない発熱 を利用する
これだけでは、よく分からないと思いますので、説明すると、一般に原子番号の大きい元素は、その原子核にエネルギーを蓄えていると考えてもらうとよいと思います。
しかし崩壊しない元素もあり、"特別な元素"のウランなどは、崩壊してエネルギーを放出します。
では、その蓄えているエネルギーは、何が一番の源なのか。
広い宇宙で起こる超新星爆発です。この爆発で無数の放射性同位元素が産まれ永い時間とともに消えていきますが、まだ天然に残っているものを原子力では使用しています。
つまり大きな元素の原子核は、「電池」みたいなものと例えられるでしょう。
星 (恒星) の一生と多少おおざっぱですが絡めていきましょう。太陽より数倍質量のある恒星は、
水素を燃料に核融合をし、宇宙空間にエネルギーを放出し、
水素が無くなると少しずつ重い元素で核融合をしていきます。
しかしこれには、限度があり「鉄」が終着点です。
そこまでいくと、膨張した恒星は、その大きさを維持する事が出来なくなり、重力との釣り合いが
取れなくなり超新星爆発などを起こし、鉄より重い元素を生成します。
その際、爆発のエネルギーの一部を原子核が蓄えます。
それを核分裂として利用しているのが、原子力です。
次の表は、理屈の上で放出できるエネルギーを表したもので、縦軸は放出エネルギーの"度合"
横軸が原子核の質量数となっております。
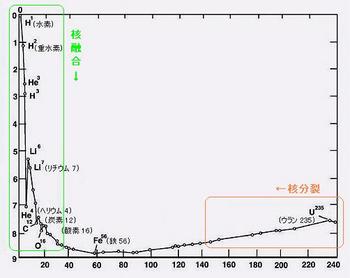
これを見ると、"融合"と"分裂"と全く反対の反応が、鉄やニッケルに向かう原子核の反応だと
分かると思います。
次のグラフを説明上、アレンジして使用させて頂きました。
( 引用元: Wikipedia 英語版 )
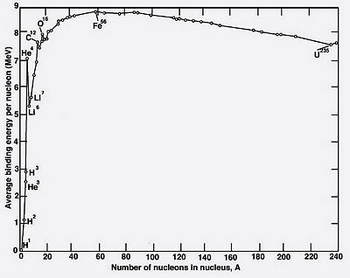
( 縦軸: 核子一個当りの結合エネルギー )
( 横軸: 質量数 )
核分裂の母 マイトナー博士 [読めばぁ~]
皆さんは、核分裂・核融合という言葉を耳にするでしょう。
原子核が分裂または融合する全く反対の反応ですが、
どちらも質量欠損により莫大なエネルギーが出ます。
核分裂の方の反応を利用しているのが、原子力発電です。
この核分裂を発見したのが、一人の女性だと聞いたら、女性の方もびっくりするかもしれません。
ウィーン出身の天才物理学者マイトナー博士です。
彼女は今から100年くらい前にあるアイデアを考え、研究を始めます。
「ウランの原子核に中性子をぶつけると、新しい元素が、出来るかもしれない。」
天然に存在する最も重い元素であったウランの原子核に、中性子をぶつける事で
さらに重い新しい元素を作ってみようという純粋なアイデアです。
しかし当時このアイデアは、ほとんど誰からも、注目されませんでした。
物理学者として優れ、男性に引けをとらないほどでしたが、
欧州でも当時女性の物理学者など、ほとんどいなく、
またアインシュタインが発表した相対性理論に注目が集まっていた頃だったかもしれません。
しかし彼女は熱心に何年も研究を続けます。
「新元素」の検出に、化学者の実験での協力を得て、地道に実験を繰返してました。
しかし、ヨーロッパ・第二次世界大戦と言えば、その単語を書かなくても思い浮かぶ
独裁者が徐々に台頭し、その猛威が彼女の身にも襲いかかります。
何度も滞まる意思だったようですが、最後は命からがら他国に逃げる事態になります。
それでも彼女は諦めずに、他国で実験についてのやりとりをしながら、研究を続けます。
実験の結果は、彼女のアイデアとは逆に元素が検出されると、軽い元素だけとの連絡でした。
そこで彼女はウラン原子核が分裂しているのではと予想し、研究を続けます。
そして原子核が分裂する核分裂を発見します。
その際質量欠損で出る莫大なエネルギーは、相対性理論通りでもあったとき、
思いもしない結論に当の彼女自身すごく驚いたことでしょう。
こうなるともう他の研究者もこぞって、同じ実験をはじめ、大騒ぎな状態になりました。
しかしこんな大発見をした彼女は、ノーペル賞を受賞していません。
もう10年でも時が、前後にずれていたら、きっと博士の運命は違っていたかもしれません。
それにその後応用研究がなされ「先に作られては・・・」と戦争に利用されることも
無かったかもしれません。
もちろん彼女はそのような計画の参加の打診を断っています。
一方実験で協力した化学者は、ほどなくノーベル化学賞を受賞します。
この実験、相当繰返さないと結果が検出されないのではないでしょうか。
確かに当時、天然ウランのなかの1%未満の同位体ウラン235が核分裂し、
軽い元素を検出するのは、高度な実験がなされての事です。
平和になり、晩年、原子力発電が増えていくのをどのような想いで、博士は見ていたことでしょう。
マイトナー博士がもし、現在の人類の原子力の利用に点数を付けるとしたら、
半分ももらえるかと思うのは、思い過ごしでしょうか。
核融合については、現在の技術ではまだ実用化には、到っていません。
しかし、私たちに身近な太陽は、核融合により莫大なエネルギーを宇宙に放出し、
地球に届く極々一部が、気象から生態系はたまた人類の活動に影響を与えます。
自動詞と他動詞 [英語]
英語を考えるうえでは、意識した方が、理解が深まります。
例えば「揺れる」と「揺らす」・「驚く」と「驚ろかす」。
「揺れる」・「驚く」は、日本語で考えても、~がの主語が必要になります。
つまり「揺れる」・「驚く」は、自らが動作するので「自動詞」と言います。
「揺らす」・「驚ろかす」も、日本語で考えて、何をの目的語が必要になります。
つまり「揺らす」・「驚ろかす」は、他のものが動作するので「他動詞」と言います。
ここで5文型を思い浮かべてみてください。
第1・第2文型は、目的語がありません。つまりこの文型の動詞は、「自動詞」で、
主語が、何らかの動作・状態を表した文になります。
第3~5文型は、目的語があります。つまりこの文型の動詞は、「他動詞」で、
主語が目的語に対し、何らかの動作・状態をした文になります。
ここで気を付けたいのは、日本語と比べて、
英語では、「自動詞」のみ 「他動詞」のみの用法しか持たない動詞がかなり多い事です。
例えば、単語のsurprise「驚ろかす」には、「他動詞」のみの用法しかありません。
ここで、目的語を主語にする受動態の表現を使います。
もともとの(他)動詞の意味 「~された」 × 受動態の「~された」 → 「~した」・「~する」
そんな訳で受動態の学習で、surpriseが、ワンパターンに必ずと言ってよいほど登場します。
( 小生は、あまりのワンパターンさに釈然としなかった覚えがあります )
つまり動詞の意味上の制限を、受動態にすることで、能動態の意味を持たせるとも言えるでしょう。
これもまた英語では、まず主語が必ず置かれる要因の1つになっているかもしれません。
モル [理科]
モルの定義は、こんな感じですよね。
原子の炭素12を アボガドロ数 ( 6.022・・・× 10の23乗 ) 個
集めたものを 12g とする。
定義文など一字一句正確に書けても、理解したと思い込むだけで百害あって一利も無い。
正しい理解と運用との間には、かなりのギャップが有る。
要するに全ての原子・分子に関して、アボガドロ数 個 集めることで
日常の重さのグラム(g)と関連付けたのがモル (mol) です。
つまり、1モルの炭素原子と言われたら12gで、
同様に周期表より 水素原子は1gで、酸素原子は16gで、
ナトリウム原子は23gで、塩素原子は35.5gになります。
2つの原子で分子になる元素の単体の気体1モルの
分子量は、水素は2gで、酸素は32gで、塩素は71gに当然なってきます。
化合物1モル場合は、構成する原子ごとに、足して分子量をもとめます。
水 18g 塩化ナトリウム 58.5g 水酸化ナトリウム 40g
次の反応式の具体例として揚げましたが、
実際の問題では、まずその物質1モルのグラムの重量を用意すればいいでしょう。
これをモルで説明すると、食塩水を電気分解して、
それぞれ 2モルの塩化ナトリウム・水から、
2モルの水酸化ナトリウムと1モルずつの塩素ガスと水素ガスが生産されると、なります。
当たり前になり高校では、特に触れませんが、質量保存の法則も成り立っています。
塩化ナトリウム 117g と 水 36g
( 溶解度の制約から、余る水に塩化ナトリウムの供給するカラクリが必要 ) から、
水酸化ナトリウム 80g と 塩素ガス 71g 水素ガス 2g が生成。
実際のモルの問題では、
水酸化ナトリウム 400g を得るために、必要な塩化ナトリウムの量を出したり、
アボガドロ数を絡めて必要な分子の個数が問われたりします。
また、気体のある反応なら、標準状態 ( 273K ( 0 ℃), 1気圧 ) で、
どんな気体も 1 mol = 22.4ℓ とみなせるを使い、
何リットル発生するか、あるいは逆に発生したリットルから、
モル数や分子の個数を問われたりもします。
まあ、モルを使った問題は、炭化水素の燃焼の問題からが普通なのですが、
塩素の原子量の話も入れたく、塩酸とアルカリの中和にすれば、モルの必要性が伝わりにくそうで、
なら有機化学ではいきなり感があり、多少溶解度は苦しいが、上の反応式を使ってみました。
皆さんのなかには、ところで、なぜモルの定義は、わざわざ炭素12を使い、
「水素 1g を基準にしない」のかと思うかもしれません。
これは、化学の話と違いますが、質量欠損の話が絡んでくるからです。
モルを考える上では、炭素12が基準のアボガドロ数は、不変です。
水素は、質量欠損が無いので、1g より少し重くなります。水素は軽い元素ですし、差は当然無視しますが、割合で見ると他の元素より大きくなります。
逆に、鉄やニッケルに適用すると、炭素12より質量欠損しているので、それぞれの原子量より僅かに軽くなります。
炭素12を基準にし求めた、アボガドロ数を使うのは、
「平均的」で他の元素にも使えるからと言えるでしょう。
原子量とモルの必要性 [理科]
モルの概略の前に、原子量について見ておきましょう。
原子量とは、同位体を加味した、その原子の重さを数値化したものです。
たいてい問題に与えられてるか、周期表の元素記号の下等を参照する指示があるので、 覚えておく数値ではありません。
もし、同位体が無ければ、原子量は、その元素の質量数になります。
同位体が複数あれば、質量数とその元素固有の同位体の比からの加重平均の値になります。
皆さんのなかに、質量数と原子量の関連は解っているので、
よく使う原子量 塩素 35.5 が小数になるのに違和感を感じてしまう事があるようです。
塩素は、原子番号17 (奇数) なので、質量数35と37 (中性子が偶数) が安定同位体で、
比のバランスが質量数35に偏っているため、上の値になります。
ところで、質量数も原子量も、日常使う重さとは全く無関係だと、今までの話から分ると思います。
これでは、例えば多少生活に身近かな重曹 (NaHCO3) を100g もし化学合成しようとしても、
原材料が 何g 必要か見当もつかない。
原子量と化学産業・ビジネスをつなげる必要性から、モルの概念が考え出されました。
この反応式は、工業的な、水酸化ナトリウムと塩素ガスの製造工程ですが、複雑ではないため
テキストに電気分解として載っているものもあります。
これを見て「例えば200gの岩塩 (塩化ナトリウム) と 200gの水から、
水酸化ナトリウム200g と塩素ガス100g と水素ガス 100g」は、出来ません。
「質量保存の法則が成り立っている」間違った思考のたまたまの偶然の一致です。
原子量の今までの話の通り、原子はそれぞれの重さが違うからです。
工業化までは、ビーカー等の実験室レベルでは、必要とする化学反応が完全でも、
少し規模を大きくした実証レベルで、温度や圧力等の条件の不均一ムラから、
一部未反応だったり、意図しない副産物が生成されますし、
さらに採算レベルにする歩留りして、操業レベルの規模にするまでには、
クリアしていく事が、山ほどあります。
オームの法則 (その2) [理科]
抵抗が複数ある回路を見ていきましょう。
直列回路
つまり、直列回路では、
電圧は抵抗に正比例して
V1:V2 = R1:R2の関係が成り立っています。
並列回路
つまり、並列回路では、
電流は抵抗に反比例して
I1:I2 = R2:R1の関係が成り立っています。
あとは、ある程度の正しく考えた時間が必要なので、具体的に問題演習をして、
受験まで覚えていられるように定着させておきましょう。
いずれ、次のような複合した回路も、また学習するように戻るかもしれません。
小生の頃、定期テストで普通に出題され、抵抗値がある問題は、正答率もわるくは無かった。
少し考えてみてください。
オームの法則 (その1) [理科]
間違わなければ、人それぞれの方法で覚えればいいですが、電流や抵抗を求める際、
分母と分子を間違えて逆数を回答してしまわないように注意しましょう。
パターン化せず、上の公式のみ覚えて、電流を求めるなら、両辺を抵抗で割り、
抵抗を求めるなら、両辺を電流で割った式を
余白にメモしておいて問題を解くのもいいでしょう。
次に回路ごとの抵抗値の計算をみましょう。
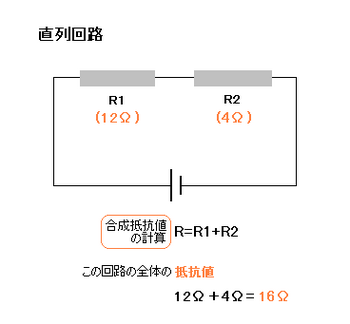
つまり直列回路では、抵抗をつなぐほど抵抗値は大きくなります。
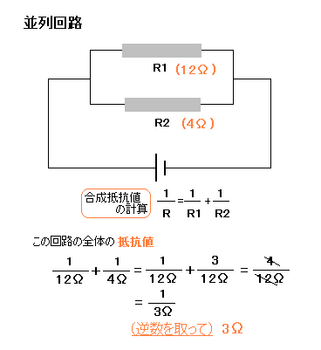 逆数の扱いに慣れてください
逆数の扱いに慣れてくださいつまり並列回路では、抵抗をつなぐほど抵抗値は小さくなります。
家の電気配線は、どこも同じ電圧にする必要で、この並列つなぎになっています。
ありがとう って言ってみよう [読めばぁ~]
高校受験等もほとんどの皆さんが、終わったと思う。おつかれさまでした。
どんな結果が出てても、いささか偉そうな言い方をさせてもらえれば、
大きな1つの節目を、通り過ぎたにすぎないと感じます。それも、多分初めての。
もちろん中学の受験も試験を受ける主体は、自分。
でも、いろんな事を考えたり、悩んだり、自分の中に生まれる煩悩・不安と向き合い、
それと、自分でどう織り合いをつけながら、受験に臨むか。きっと中学受験の比ではないだろう。
実は、
残念ながら オ・ト・ナ(になって)も日々織り合いをつけながら、生きていく。
終わりが無いというか、結論が無いというか、解消されることは無い。
でもどんなに世の中変わっても、皆んな人生一度。昔も今も変わることは無い。
だから心配は要らない、昔の先人だって、同じように織り合いをつけながら生きてきたから。
どんな経験をし、それにどう向き合ったか。それを振り返って消化してみるのも大事な作業。
自分で、
初めて自分をプロデュースする高校受験。落着いたら過程を振り返ってみよう。
いつもいい結果が出るとは限らないから。そう、だから過程が大事になる。
高校に入れば、やる中身は変わる。いつまでも、振り返ってばかりもいられ無い。
だから、今のうち振り返っておこう。
そして、
いつもうるさくて、自分以上に気にしてくれた、一番身近な人を思い浮かべたら、
「ありがとう」って、ためらわず言ってみよう。
びっくりするかもしれない。でも自分一人で出した結果では無い事に気付いて欲しい。
確かに勉強は、孤独が普通だろう。でも支えが無ければ、勉強すら出来ないのだから。
な~に、これからも世話になるんだし、言い慣れておこう。
質量数と同位体 [理科]
そのまわりの決まった軌道上に電子(e ̄)があり、
その軌道の大きさで、原子の大きさは、決定され、
プラスの電気を持つ陽子の数とマイナスの電気を持つ電子(e ̄)が同数のとき、
原子は、電気的に釣合っており、
イオンは、電子(e ̄)の数が違うため、電気を帯びています。
今度は原子の重さについて考えてみましょう。
電子は考慮に入れ無くていいくらいの、重さしかないので、
原子核にある、陽子の個数と中性子の個数を足した
質量数で、表現します。
元素記号の左上に質量数は書きます。
例えば
左は原子番号6の炭素質量数12を表し、中性子の数は6
右は原子番号17の塩素質量数37を表し、中性子の数は20になります。
そして同位体とは、同じ元素でも質量数が違う
( つまり中性子の数が違う )原子を言います。
自然界にある、元素は複数の同位体が固有の割合で混在しているものも多くあります。
例えば炭素には、質量数13のものが少量、塩素では、質量数35のものが大半です。
質量数が違っても、同じ元素であれば、化学的性質の違いは、極めて僅かです。
原子の外側の電子が、それをほとんど決めるからです。
神様は、電子軌道の空間を、大きくし過ぎたようで、
生物からモノ全てどんなに重くてもスカスカとも考えられます。
でも、2桁くらいの原子番号から偶数の元素は、同位体の数が多く
奇数の元素は、同位体の数が少ないようにしているようです。
これは原子核の陽子の個数が、偶数のときは、中性子の個数は、偶数も奇数もあるのに、
陽子の個数が、奇数になると、中性子の個数は偶数だけになる傾向があるからようです。
んー何かありそうな。もったえぶりです。
なお、同位体の数が多いから、その元素が多くあるとは限りません。
多品種少量タイプもイメージしてみてください。
また、半減期のある程度ある同位体・人工同位体は、考慮していません。
使役動詞 [英語]
動詞に+ 目的語 + toなし不定詞 (原形不定詞)が、つづきます。
知覚動詞と一緒に確認しておきましょう。
一般に、haveと比べて、
makeでは強制的にさせる意味合いがあり、
letでは( その目的語の意向に添って )させておく意味合いが出て来ます。
He had me go to the station. 「彼は、駅に私を行かせた。」
The teacher made students study English. 「先生は、生徒に英語の勉強をさせた。」
He let his children help himself. 「彼は、子供たちに手伝わせといた。」
また、知覚動詞と同じく受動態にすると、to不定詞に変わります。
Students were made to study English (by the teacher).
getにも使役動詞の用法もありますが、+ 目的語+ to不定詞が、つづきます。
He got me to go to the station.



