モル [理科]
そこでやっとモル (mol) です。
モルの定義は、こんな感じですよね。
原子の炭素12を アボガドロ数 ( 6.022・・・× 10の23乗 ) 個
集めたものを 12g とする。
定義文など一字一句正確に書けても、理解したと思い込むだけで百害あって一利も無い。
正しい理解と運用との間には、かなりのギャップが有る。
要するに全ての原子・分子に関して、アボガドロ数 個 集めることで
日常の重さのグラム(g)と関連付けたのがモル (mol) です。
つまり、1モルの炭素原子と言われたら12gで、
同様に周期表より 水素原子は1gで、酸素原子は16gで、
ナトリウム原子は23gで、塩素原子は35.5gになります。
2つの原子で分子になる元素の単体の気体1モルの
分子量は、水素は2gで、酸素は32gで、塩素は71gに当然なってきます。
化合物1モル場合は、構成する原子ごとに、足して分子量をもとめます。
水 18g 塩化ナトリウム 58.5g 水酸化ナトリウム 40g
次の反応式の具体例として揚げましたが、
実際の問題では、まずその物質1モルのグラムの重量を用意すればいいでしょう。
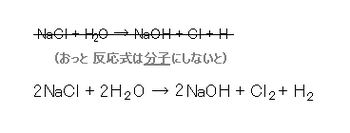 同じ反応式です。
同じ反応式です。
これをモルで説明すると、食塩水を電気分解して、
それぞれ 2モルの塩化ナトリウム・水から、
2モルの水酸化ナトリウムと1モルずつの塩素ガスと水素ガスが生産されると、なります。
当たり前になり高校では、特に触れませんが、質量保存の法則も成り立っています。
塩化ナトリウム 117g と 水 36g
( 溶解度の制約から、余る水に塩化ナトリウムの供給するカラクリが必要 ) から、
水酸化ナトリウム 80g と 塩素ガス 71g 水素ガス 2g が生成。
実際のモルの問題では、
水酸化ナトリウム 400g を得るために、必要な塩化ナトリウムの量を出したり、
アボガドロ数を絡めて必要な分子の個数が問われたりします。
また、気体のある反応なら、標準状態 ( 273K ( 0 ℃), 1気圧 ) で、
どんな気体も 1 mol = 22.4ℓ とみなせるを使い、
何リットル発生するか、あるいは逆に発生したリットルから、
モル数や分子の個数を問われたりもします。
まあ、モルを使った問題は、炭化水素の燃焼の問題からが普通なのですが、
塩素の原子量の話も入れたく、塩酸とアルカリの中和にすれば、モルの必要性が伝わりにくそうで、
なら有機化学ではいきなり感があり、多少溶解度は苦しいが、上の反応式を使ってみました。
皆さんのなかには、ところで、なぜモルの定義は、わざわざ炭素12を使い、
「水素 1g を基準にしない」のかと思うかもしれません。
これは、化学の話と違いますが、質量欠損の話が絡んでくるからです。
モルを考える上では、炭素12が基準のアボガドロ数は、不変です。
水素は、質量欠損が無いので、1g より少し重くなります。水素は軽い元素ですし、差は当然無視しますが、割合で見ると他の元素より大きくなります。
逆に、鉄やニッケルに適用すると、炭素12より質量欠損しているので、それぞれの原子量より僅かに軽くなります。
炭素12を基準にし求めた、アボガドロ数を使うのは、
「平均的」で他の元素にも使えるからと言えるでしょう。
モルの定義は、こんな感じですよね。
原子の炭素12を アボガドロ数 ( 6.022・・・× 10の23乗 ) 個
集めたものを 12g とする。
定義文など一字一句正確に書けても、理解したと思い込むだけで百害あって一利も無い。
正しい理解と運用との間には、かなりのギャップが有る。
要するに全ての原子・分子に関して、アボガドロ数 個 集めることで
日常の重さのグラム(g)と関連付けたのがモル (mol) です。
つまり、1モルの炭素原子と言われたら12gで、
同様に周期表より 水素原子は1gで、酸素原子は16gで、
ナトリウム原子は23gで、塩素原子は35.5gになります。
2つの原子で分子になる元素の単体の気体1モルの
分子量は、水素は2gで、酸素は32gで、塩素は71gに当然なってきます。
化合物1モル場合は、構成する原子ごとに、足して分子量をもとめます。
水 18g 塩化ナトリウム 58.5g 水酸化ナトリウム 40g
次の反応式の具体例として揚げましたが、
実際の問題では、まずその物質1モルのグラムの重量を用意すればいいでしょう。
これをモルで説明すると、食塩水を電気分解して、
それぞれ 2モルの塩化ナトリウム・水から、
2モルの水酸化ナトリウムと1モルずつの塩素ガスと水素ガスが生産されると、なります。
当たり前になり高校では、特に触れませんが、質量保存の法則も成り立っています。
塩化ナトリウム 117g と 水 36g
( 溶解度の制約から、余る水に塩化ナトリウムの供給するカラクリが必要 ) から、
水酸化ナトリウム 80g と 塩素ガス 71g 水素ガス 2g が生成。
実際のモルの問題では、
水酸化ナトリウム 400g を得るために、必要な塩化ナトリウムの量を出したり、
アボガドロ数を絡めて必要な分子の個数が問われたりします。
また、気体のある反応なら、標準状態 ( 273K ( 0 ℃), 1気圧 ) で、
どんな気体も 1 mol = 22.4ℓ とみなせるを使い、
何リットル発生するか、あるいは逆に発生したリットルから、
モル数や分子の個数を問われたりもします。
まあ、モルを使った問題は、炭化水素の燃焼の問題からが普通なのですが、
塩素の原子量の話も入れたく、塩酸とアルカリの中和にすれば、モルの必要性が伝わりにくそうで、
なら有機化学ではいきなり感があり、多少溶解度は苦しいが、上の反応式を使ってみました。
皆さんのなかには、ところで、なぜモルの定義は、わざわざ炭素12を使い、
「水素 1g を基準にしない」のかと思うかもしれません。
これは、化学の話と違いますが、質量欠損の話が絡んでくるからです。
モルを考える上では、炭素12が基準のアボガドロ数は、不変です。
水素は、質量欠損が無いので、1g より少し重くなります。水素は軽い元素ですし、差は当然無視しますが、割合で見ると他の元素より大きくなります。
逆に、鉄やニッケルに適用すると、炭素12より質量欠損しているので、それぞれの原子量より僅かに軽くなります。
炭素12を基準にし求めた、アボガドロ数を使うのは、
「平均的」で他の元素にも使えるからと言えるでしょう。
原子量とモルの必要性 [理科]
高校に入ると化学で、モル (mol) を習います。
モルの概略の前に、原子量について見ておきましょう。
原子量とは、同位体を加味した、その原子の重さを数値化したものです。
たいてい問題に与えられてるか、周期表の元素記号の下等を参照する指示があるので、 覚えておく数値ではありません。
もし、同位体が無ければ、原子量は、その元素の質量数になります。
同位体が複数あれば、質量数とその元素固有の同位体の比からの加重平均の値になります。
皆さんのなかに、質量数と原子量の関連は解っているので、
よく使う原子量 塩素 35.5 が小数になるのに違和感を感じてしまう事があるようです。
塩素は、原子番号17 (奇数) なので、質量数35と37 (中性子が偶数) が安定同位体で、
比のバランスが質量数35に偏っているため、上の値になります。
ところで、質量数も原子量も、日常使う重さとは全く無関係だと、今までの話から分ると思います。
これでは、例えば多少生活に身近かな重曹 (NaHCO3) を100g もし化学合成しようとしても、
原材料が 何g 必要か見当もつかない。
原子量と化学産業・ビジネスをつなげる必要性から、モルの概念が考え出されました。
この反応式は、工業的な、水酸化ナトリウムと塩素ガスの製造工程ですが、複雑ではないため
テキストに電気分解として載っているものもあります。

これを見て「例えば200gの岩塩 (塩化ナトリウム) と 200gの水から、
水酸化ナトリウム200g と塩素ガス100g と水素ガス 100g」は、出来ません。
「質量保存の法則が成り立っている」間違った思考のたまたまの偶然の一致です。
原子量の今までの話の通り、原子はそれぞれの重さが違うからです。
工業化までは、ビーカー等の実験室レベルでは、必要とする化学反応が完全でも、
少し規模を大きくした実証レベルで、温度や圧力等の条件の不均一ムラから、
一部未反応だったり、意図しない副産物が生成されますし、
さらに採算レベルにする歩留りして、操業レベルの規模にするまでには、
クリアしていく事が、山ほどあります。
モルの概略の前に、原子量について見ておきましょう。
原子量とは、同位体を加味した、その原子の重さを数値化したものです。
たいてい問題に与えられてるか、周期表の元素記号の下等を参照する指示があるので、 覚えておく数値ではありません。
もし、同位体が無ければ、原子量は、その元素の質量数になります。
同位体が複数あれば、質量数とその元素固有の同位体の比からの加重平均の値になります。
皆さんのなかに、質量数と原子量の関連は解っているので、
よく使う原子量 塩素 35.5 が小数になるのに違和感を感じてしまう事があるようです。
塩素は、原子番号17 (奇数) なので、質量数35と37 (中性子が偶数) が安定同位体で、
比のバランスが質量数35に偏っているため、上の値になります。
ところで、質量数も原子量も、日常使う重さとは全く無関係だと、今までの話から分ると思います。
これでは、例えば多少生活に身近かな重曹 (NaHCO3) を100g もし化学合成しようとしても、
原材料が 何g 必要か見当もつかない。
原子量と化学産業・ビジネスをつなげる必要性から、モルの概念が考え出されました。
この反応式は、工業的な、水酸化ナトリウムと塩素ガスの製造工程ですが、複雑ではないため
テキストに電気分解として載っているものもあります。
これを見て「例えば200gの岩塩 (塩化ナトリウム) と 200gの水から、
水酸化ナトリウム200g と塩素ガス100g と水素ガス 100g」は、出来ません。
「質量保存の法則が成り立っている」間違った思考のたまたまの偶然の一致です。
原子量の今までの話の通り、原子はそれぞれの重さが違うからです。
工業化までは、ビーカー等の実験室レベルでは、必要とする化学反応が完全でも、
少し規模を大きくした実証レベルで、温度や圧力等の条件の不均一ムラから、
一部未反応だったり、意図しない副産物が生成されますし、
さらに採算レベルにする歩留りして、操業レベルの規模にするまでには、
クリアしていく事が、山ほどあります。
オームの法則 (その2) [理科]
抵抗が1つのケースや合成抵抗の次に
抵抗が複数ある回路を見ていきましょう。
直列回路
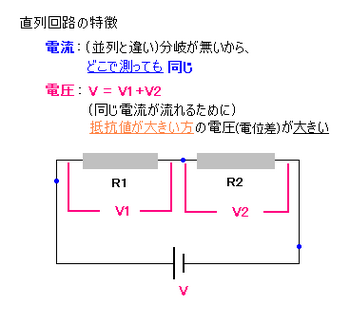
つまり、直列回路では、
電圧は抵抗に正比例して
V1:V2 = R1:R2の関係が成り立っています。
並列回路
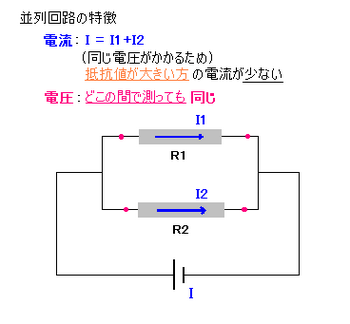
つまり、並列回路では、
電流は抵抗に反比例して
I1:I2 = R2:R1の関係が成り立っています。
あとは、ある程度の正しく考えた時間が必要なので、具体的に問題演習をして、
受験まで覚えていられるように定着させておきましょう。
いずれ、次のような複合した回路も、また学習するように戻るかもしれません。
小生の頃、定期テストで普通に出題され、抵抗値がある問題は、正答率もわるくは無かった。
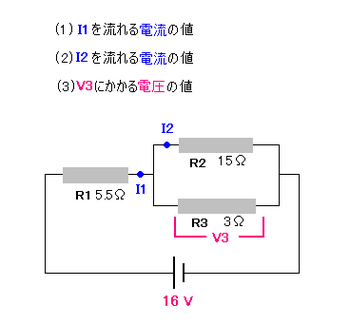
少し考えてみてください。
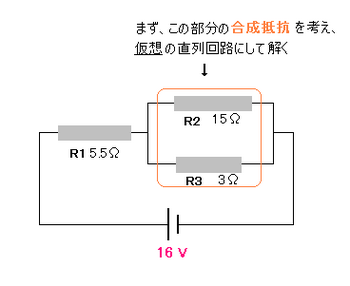

抵抗が複数ある回路を見ていきましょう。
直列回路
つまり、直列回路では、
電圧は抵抗に正比例して
V1:V2 = R1:R2の関係が成り立っています。
並列回路
つまり、並列回路では、
電流は抵抗に反比例して
I1:I2 = R2:R1の関係が成り立っています。
あとは、ある程度の正しく考えた時間が必要なので、具体的に問題演習をして、
受験まで覚えていられるように定着させておきましょう。
いずれ、次のような複合した回路も、また学習するように戻るかもしれません。
小生の頃、定期テストで普通に出題され、抵抗値がある問題は、正答率もわるくは無かった。
少し考えてみてください。
オームの法則 (その1) [理科]
オームの法則をみていきましょう。
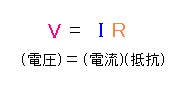
間違わなければ、人それぞれの方法で覚えればいいですが、電流や抵抗を求める際、
分母と分子を間違えて逆数を回答してしまわないように注意しましょう。
パターン化せず、上の公式のみ覚えて、電流を求めるなら、両辺を抵抗で割り、
抵抗を求めるなら、両辺を電流で割った式を
余白にメモしておいて問題を解くのもいいでしょう。
次に回路ごとの抵抗値の計算をみましょう。
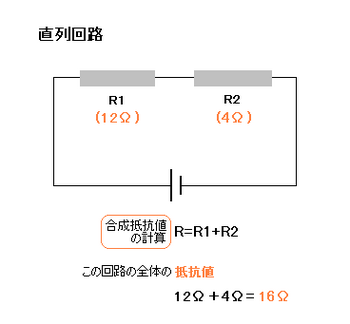
つまり直列回路では、抵抗をつなぐほど抵抗値は大きくなります。
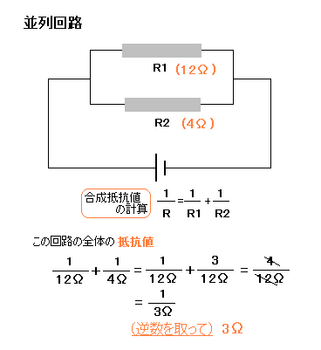 逆数の扱いに慣れてください
逆数の扱いに慣れてください
つまり並列回路では、抵抗をつなぐほど抵抗値は小さくなります。
家の電気配線は、どこも同じ電圧にする必要で、この並列つなぎになっています。
間違わなければ、人それぞれの方法で覚えればいいですが、電流や抵抗を求める際、
分母と分子を間違えて逆数を回答してしまわないように注意しましょう。
パターン化せず、上の公式のみ覚えて、電流を求めるなら、両辺を抵抗で割り、
抵抗を求めるなら、両辺を電流で割った式を
余白にメモしておいて問題を解くのもいいでしょう。
次に回路ごとの抵抗値の計算をみましょう。

つまり直列回路では、抵抗をつなぐほど抵抗値は大きくなります。
 逆数の扱いに慣れてください
逆数の扱いに慣れてくださいつまり並列回路では、抵抗をつなぐほど抵抗値は小さくなります。
家の電気配線は、どこも同じ電圧にする必要で、この並列つなぎになっています。
質量数と同位体 [理科]
原子は、その中心に大きさに比べはるかに小さい、陽子と中性子からなる原子核と
そのまわりの決まった軌道上に電子(e ̄)があり、
その軌道の大きさで、原子の大きさは、決定され、
プラスの電気を持つ陽子の数とマイナスの電気を持つ電子(e ̄)が同数のとき、
原子は、電気的に釣合っており、
イオンは、電子(e ̄)の数が違うため、電気を帯びています。
今度は原子の重さについて考えてみましょう。
電子は考慮に入れ無くていいくらいの、重さしかないので、
原子核にある、陽子の個数と中性子の個数を足した
質量数で、表現します。
元素記号の左上に質量数は書きます。
例えば
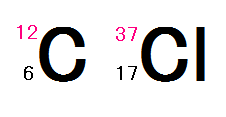
左は原子番号6の炭素質量数12を表し、中性子の数は6
右は原子番号17の塩素質量数37を表し、中性子の数は20になります。
そして同位体とは、同じ元素でも質量数が違う
( つまり中性子の数が違う )原子を言います。
自然界にある、元素は複数の同位体が固有の割合で混在しているものも多くあります。
例えば炭素には、質量数13のものが少量、塩素では、質量数35のものが大半です。
質量数が違っても、同じ元素であれば、化学的性質の違いは、極めて僅かです。
原子の外側の電子が、それをほとんど決めるからです。
神様は、電子軌道の空間を、大きくし過ぎたようで、
生物からモノ全てどんなに重くてもスカスカとも考えられます。
でも、2桁くらいの原子番号から偶数の元素は、同位体の数が多く
奇数の元素は、同位体の数が少ないようにしているようです。
これは原子核の陽子の個数が、偶数のときは、中性子の個数は、偶数も奇数もあるのに、
陽子の個数が、奇数になると、中性子の個数は偶数だけになる傾向があるからようです。
んー何かありそうな。もったえぶりです。
なお、同位体の数が多いから、その元素が多くあるとは限りません。
多品種少量タイプもイメージしてみてください。
また、半減期のある程度ある同位体・人工同位体は、考慮していません。
そのまわりの決まった軌道上に電子(e ̄)があり、
その軌道の大きさで、原子の大きさは、決定され、
プラスの電気を持つ陽子の数とマイナスの電気を持つ電子(e ̄)が同数のとき、
原子は、電気的に釣合っており、
イオンは、電子(e ̄)の数が違うため、電気を帯びています。
今度は原子の重さについて考えてみましょう。
電子は考慮に入れ無くていいくらいの、重さしかないので、
原子核にある、陽子の個数と中性子の個数を足した
質量数で、表現します。
元素記号の左上に質量数は書きます。
例えば
左は原子番号6の炭素質量数12を表し、中性子の数は6
右は原子番号17の塩素質量数37を表し、中性子の数は20になります。
そして同位体とは、同じ元素でも質量数が違う
( つまり中性子の数が違う )原子を言います。
自然界にある、元素は複数の同位体が固有の割合で混在しているものも多くあります。
例えば炭素には、質量数13のものが少量、塩素では、質量数35のものが大半です。
質量数が違っても、同じ元素であれば、化学的性質の違いは、極めて僅かです。
原子の外側の電子が、それをほとんど決めるからです。
神様は、電子軌道の空間を、大きくし過ぎたようで、
生物からモノ全てどんなに重くてもスカスカとも考えられます。
でも、2桁くらいの原子番号から偶数の元素は、同位体の数が多く
奇数の元素は、同位体の数が少ないようにしているようです。
これは原子核の陽子の個数が、偶数のときは、中性子の個数は、偶数も奇数もあるのに、
陽子の個数が、奇数になると、中性子の個数は偶数だけになる傾向があるからようです。
んー何かありそうな。もったえぶりです。
なお、同位体の数が多いから、その元素が多くあるとは限りません。
多品種少量タイプもイメージしてみてください。
また、半減期のある程度ある同位体・人工同位体は、考慮していません。
原子構造とイオン [理科]
はじめにイオンの話をする前に、簡単に原子について触れたいと思います。
原子の構造は、中心にその大きさに比べはるかに小さい、原子核と
そのまわりをマイナスの電気を持つ電子(e ̄)が、決まった軌道上にあります。
また、原子核には、プラスの電気を持つ陽子と中性子があり、電気的に釣合っています。
つまり、陽子と中性子でできた、原子核のまわりに電子(e ̄)があるのが、原子で、
電子の軌道の大きさで、原子の大きさは、決定されます。
生物からモノ、全ての物質、それから地球・太陽・宇宙のスミズミまで、
この重さのある3つの組合せだけで、宇宙があると考えることもできます。
神様って、やっぱりステキなタイプかもしれない。
そして、イオンは、この原子の外側の電子(e ̄)を、お互いやり取りする話になります。
原子の性質に、水素等の一部を除き、一番外側の電子を8個にして安定するが、あります。
このため一番外側の電子が1個や2個などの原子は、その電子を出したがる傾向が強くなり
一番外側の電子が6個や7個などの原子は、他から電子をもらいたがる傾向が強くなります。
例えば ナトリウム11Naは、一番外側に1個の電子があり、それを出し
Na → Na+ + e ̄ 陽イオンとして、安定したがります。
また 塩素17Clは、一番外側に7個の電子があり、他から電子をもらい
Cl + e ̄ → Cl ̄ 陰イオンとして、安定したがります。
つまり、イオンとは、原子が安定した電子配置を取った結果、
プラスやマイナスの電気を帯びたものと言えます。
希ガス 元素が、反応性に乏しいのも、もともと安定した電子配置のためと言えます。
なお陽子と中性子の重さは、ほぼ等しい。電子の重さは、陽子の約1/1836だが、
電荷は、同じ大きさ(符号は反対)。
普通の水素原子は、陽子と電子が各1個のみでできている。
また、光子・クォーク・レプトン等や電子軌道については、考慮してません。
原子の構造は、中心にその大きさに比べはるかに小さい、原子核と
そのまわりをマイナスの電気を持つ電子(e ̄)が、決まった軌道上にあります。
また、原子核には、プラスの電気を持つ陽子と中性子があり、電気的に釣合っています。
つまり、陽子と中性子でできた、原子核のまわりに電子(e ̄)があるのが、原子で、
電子の軌道の大きさで、原子の大きさは、決定されます。
生物からモノ、全ての物質、それから地球・太陽・宇宙のスミズミまで、
この重さのある3つの組合せだけで、宇宙があると考えることもできます。
神様って、やっぱりステキなタイプかもしれない。
そして、イオンは、この原子の外側の電子(e ̄)を、お互いやり取りする話になります。
原子の性質に、水素等の一部を除き、一番外側の電子を8個にして安定するが、あります。
このため一番外側の電子が1個や2個などの原子は、その電子を出したがる傾向が強くなり
一番外側の電子が6個や7個などの原子は、他から電子をもらいたがる傾向が強くなります。
例えば ナトリウム11Naは、一番外側に1個の電子があり、それを出し
Na → Na+ + e ̄ 陽イオンとして、安定したがります。
また 塩素17Clは、一番外側に7個の電子があり、他から電子をもらい
Cl + e ̄ → Cl ̄ 陰イオンとして、安定したがります。
つまり、イオンとは、原子が安定した電子配置を取った結果、
プラスやマイナスの電気を帯びたものと言えます。
希ガス 元素が、反応性に乏しいのも、もともと安定した電子配置のためと言えます。
なお陽子と中性子の重さは、ほぼ等しい。電子の重さは、陽子の約1/1836だが、
電荷は、同じ大きさ(符号は反対)。
普通の水素原子は、陽子と電子が各1個のみでできている。
また、光子・クォーク・レプトン等や電子軌道については、考慮してません。
分子と原子 [理科]
皆さんは分子と原子の区別を意識したことありますか。
分子とは、化学反応式に登場し、
単純なものから複雑なものまで、組合せが無数に存在するもの。
原子とは、分子を構成するもので、周期表にあるもののみ。
例えばH2Oは、水分子であり、水素原子2個と酸素原子1個から出来ており、
C2H5OHは、エタノール分子であり、炭素原子2個と水素原子6個と酸素原子1個から出来てます。
金属は、1つの原子で、分子になります。
また、希ガスも1つの原子で、分子になります。
原子の元素記号と、単体・化合物の分子式は、おさえておく必要があります。
元素記号は、周期表の少なめで20Ca(カルシウム)までの連続。
授業には、もう少し必要で、金属(イオン化傾向の順とついでにおさえるよい)と、
縦に、希ガス(36Krクリプトン)までとハロゲン( I ヨウ素)までで対応出来るでしょう
単体・化合物の分子式は、授業に出てくるものは、必ずおさえておいてください。
なお、イオン化傾向とは、金属を陽イオンになり易い順番に並べたものです。
K>Ba>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
希ガスは、その原子構造から、反応性が乏しく、単原子分子と言います。
化学反応式では、有機化学を中心に示性式を使うものが多く、正確に言うとエタノールの式は、分子式ではない。
分子とは、化学反応式に登場し、
単純なものから複雑なものまで、組合せが無数に存在するもの。
原子とは、分子を構成するもので、周期表にあるもののみ。
例えばH2Oは、水分子であり、水素原子2個と酸素原子1個から出来ており、
C2H5OHは、エタノール分子であり、炭素原子2個と水素原子6個と酸素原子1個から出来てます。
金属は、1つの原子で、分子になります。
また、希ガスも1つの原子で、分子になります。
原子の元素記号と、単体・化合物の分子式は、おさえておく必要があります。
元素記号は、周期表の少なめで20Ca(カルシウム)までの連続。
授業には、もう少し必要で、金属(イオン化傾向の順とついでにおさえるよい)と、
縦に、希ガス(36Krクリプトン)までとハロゲン( I ヨウ素)までで対応出来るでしょう
単体・化合物の分子式は、授業に出てくるものは、必ずおさえておいてください。
なお、イオン化傾向とは、金属を陽イオンになり易い順番に並べたものです。
K>Ba>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
希ガスは、その原子構造から、反応性が乏しく、単原子分子と言います。
化学反応式では、有機化学を中心に示性式を使うものが多く、正確に言うとエタノールの式は、分子式ではない。



